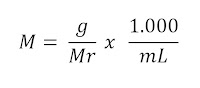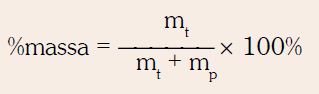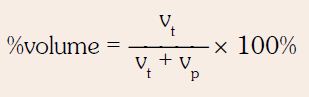SIFAT KOLIGATIF LARUTAN NON ELEKTROLIT
1. Penurunan tekanan uap
Secara ideal, tekanan uap dari pelarut volatil di atas larutan yang mengandung zat terlarut non-volatil berbanding lurus terhadap konsentrasi pelarut dalam larutan.
2. Kenaikan Titik Didih (Tb)
Titik didih dari suatu larutan adalah temperatur ketika tekanan uapnya sama dengan tekanan eksternal.
3. Penurunan Titik Beku
itik beku dari suatu larutan adalah temperatur di mana tekanan uap larutan sama dengan tekanan uap pelarut murni. Pada temperatur ini, dua fasa—pelarut padat dan larutan cair—berada dalam kesetimbangan.
4. Tekanan Osmosis
Osmosis adalah peristiwa perpindahan selektif partikel-partikel pelarut melalui membran semipermeabel dari larutan dengan konsentrasi zat terlarut yang lebih rendah ke larutan dengan konsentrasi zat terlarut yang lebih tinggi.
Sifat koligatif larutan Sifat koligatif larutan Sifat koligatif larutan Sifat koligatif larutan Sifat koligatif larutan Sifat koligatif larutan Sifat koligatif larutan
SIFAT KOLIGATIF LARUTAN ELEKTROLIT
Larutan elektrolit memiliki sifat koligatif yang lebih besar daripada nonelektrolit. Perbandingan harga sifat koligatif larutan elektrolit dengan larutan nonelektrolit dinamakan dengan faktor Van’t Hoff dan dilambangkan dengan i.
Rumus untuk menghitung sifat koligatif larutan elektrolis sebagai berikut: